آنزیم ها
آنزیمها
آنزیها ترکیباتی پروتئینی هستند که به منزله کاتالیزورهای حیاتی ممکن است سبب تغییرات مطلوب یا نامطلوب فیزیکی و شیمیایی در مواد غذایی شوند. در انجام متابولیزم مواد غذایی در اندام جانداران نیز نقش بسیار مهمی ایفا می کنند. به طور کلی مکانیزم اثر آنزیمها از طریق کاهش انرژی لازم که برای انجام بسیاری از واکنشهای شیمیایی ضروری است و به انرژی فعال کننده موسوم می باشد ظاهر می گردد .
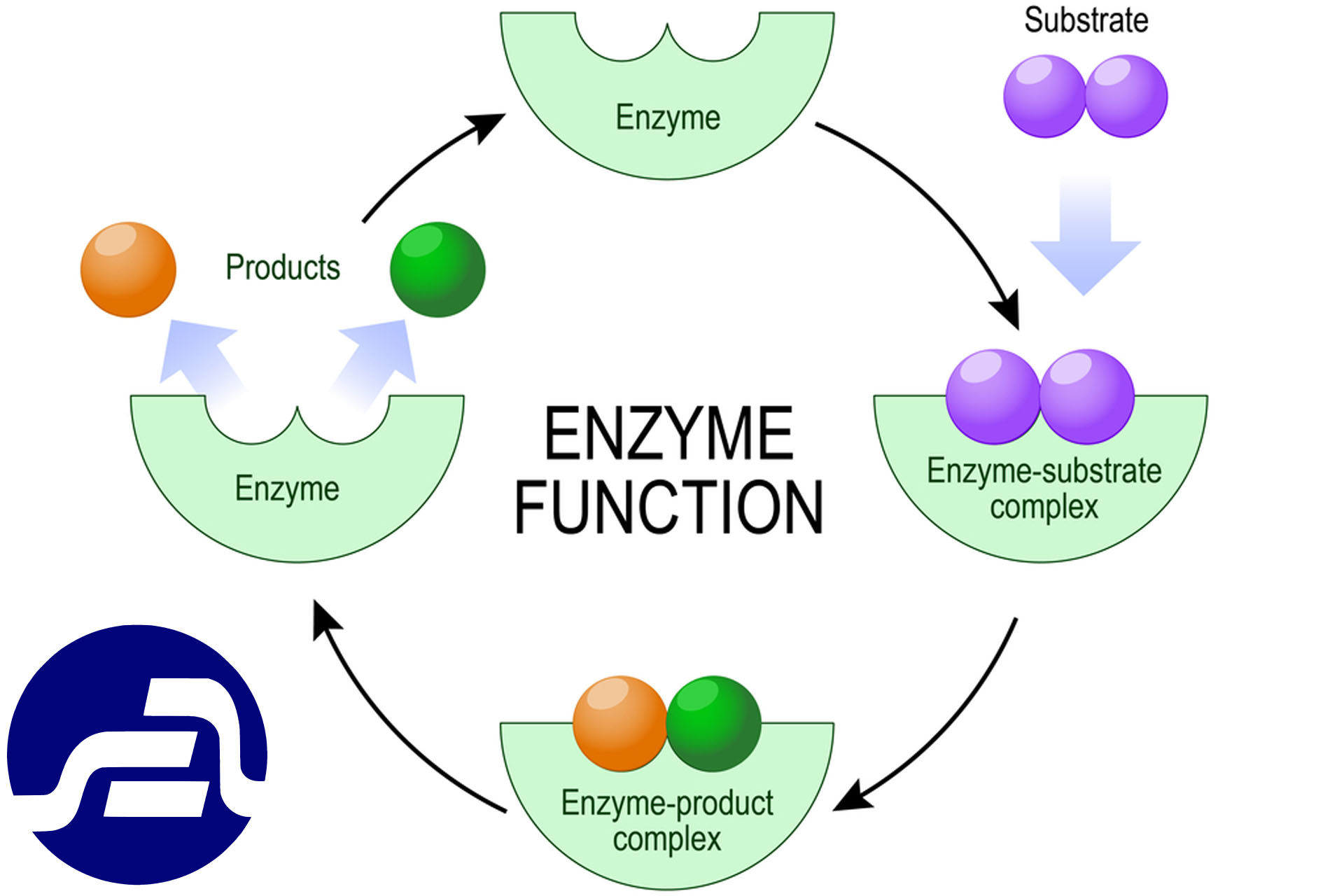
ماده ای که مورد اثر آنزیم قرار می گیرد سوبسترا نامیده می شود. آنزیم پس از ایجاد تغییرات لازم در سوبسترا و ایجاد ماده ای جدید از آن جدا می گردد و مجددا مورد استفاده قرار می گیرد. در مقایسه با کاتالیزورهای متداول شیمیایی، آنزیمها دارای دو مزیت مهم و چشمگیر هستند. یک مزیت سرعت عمل آنهاست. در میزان فعالیت چند آنزیم مشخص شده است.
به طور کلی این اختصاصی عمل کردن آنزیمها وسیله بسیار خوبی جهت شناسایی برخی مواد محسوب می شود و در بررسیهای علمی به طور مشخصی مورد استفاده قرار می گیرد. به عنوان یک مزیت جانبی همچنین باید توجه شود که آنزیمها اساسا در حرارتهای معمولی عمل می کنند که این از ایجاد صدمات حرارتی در محصول مورد نظر جلوگیری می نماید؛ در عین حال که انجام بعضی اقدامات هزینه بر ، چون به کارگیری انرژی یا ساخت دستگاههای مقاوم در برابر حرارت و فشار را منتفی می سازد.
در مواردی آنزیم را می توان مثلا به وسیله روشهای کروماتوگرافی به صورت اجزاء جدا از هم در آورد در حالی که همگی بر روی یک سوبسترای خاص و مشخص عمل می کنند. این اجزاء که از نظر ساختمانی متفاوت اما دارای سوبسترای یکسان و واحدی هستند ایزو آنزیم یا ایزوزیم گفته می شوند.
1- طبقه بندی و نامگذاری
در حدود دو دهه قبل در اتحادیه بین المللی شیمی و بیوشیمی، آنزیمها را از نظر نحوه عمل به شش گروه به صورت زیر طبقه بندی کردند:
١- اکسید و ردوکتاز ها : اینها در اکسیداسیون سیستمهای بیولژیک شرکت دارند و شامل آنزیمهایی هستند که متداولا دهیدروژناز، ردوکتاز، اکسیداز ، اکسیژناز ، هیدروکسیلاز و کاتالاز نامیده می شوند.
این کو آئزیم نیز به طور قابل برگشتی در ما ورد روزی شرکت دارد (ساختمان آن در مبحث ویتامین ها ارائه شده است) در مورد بعضی از آنزیم ها ، فلزات کوفاکتور عمل می کنند. در این موارد، فلزات با ظرفیت خود به اشکال اکسید شده در می آیند و به این ترتیب انجام تغییر عمل و اثر آنزیم را امکان پذیر می سازند. نظیر فلز آهن در آنزیم لیپوکسیژناز و مس در فنل اکسیداز ها. یک قسمت به محل اتصال موسوم است و دیگری به محل کاتالیزوری، طب وتا سوبسترا برای آنکه در محل اتصال قرار گیرد باید دارای شکل متناسب با این محل باشد تا کار کاتالیزوری و رسیدن به محصول مورد نظر در محل کاتالیزوری به درستی صورت گیرد. اگرچه محل فعال بخش کوچکی از مولكول آنزیم را تشکیل می شود و بقیه مولکول اقدامات کاتالیزوری است، اما باید توجه داشت که قسمت اخیر از نظر فضایی ساختمانی را به وجود می آورد که در واقع پشتیبان و افراشم آورده وضعیت و شکل ساختمانی مناسب برای محل فعال می باشد. کوفاکتور نیز در مجاورت این محل فعال قرار می گیرد و نقش خود را ایفا می کند. محل فعال آنزیم کربوکسی پپتیداز و نحوه قرار گرفتن بخشی از انتهای C زنجيره پپتیدی به شکلی خاص همراه با ارتباط به صورتی مناسب با اسید های آمینه موجود در این محل را نشان می دهد. همچنین وضعیت شکسته شدن ملکول آمیلوز و جدا شدن مالتوز از آن در محل فعال آنزیم بتا ۔ آمیلاز نشان داده شده است. همان طور مشخص است، در محل فعال، چهار نقطه خاص وجود دارد که با برقرار کردن ارتباط لازم، عمل شکستن پیوند. در ملکول آمیلوز را انجام می دهند.
بسیاری از مواد وجود دارند که در جریان انجام عمل آنزیم حالت می کشند و این فراینده را به شکلی متوقف می نمایند. این مواد موسوم به بازدارنده می باشند. یک را به دو شکل رقابتی و غیر رقایتی ممکن است در واکنشهای آنزیمی عمل کند. بازدارنده دارای ساختمانی شیریه سوبستر است از این نظر می تواند در قسمت اقوال آنزیم قرار گیرد و آن را از دسترس سوبسترا خارج سازد. در واقع در اینجا را دارند و به منزله یک کلید غلط برای قفل عمل می کنند. ، باز دارند و در ویلاهای غیر از محل فعال به آنزیم متصل می گردد و با اعمال نیرو و کش مخصوصی بر روی ساختمان آنزیم باعث می شود که شکل خاص ساختمانی آنزیم در محل کمال تغییر کند؛ به طوری که سوبسترا دیگر نمی تواند به طور لازم و مناسب در این محل قرار گیرد تا عمل آنزیمی انجام پذیرد با شرحی که گذشت، بازدارنده ها می توانند راههای متابولیک مهمی را مسدود سازند از این ویژگی در دارو سازی به میزان زیادی استفاده می شود و داروهایی که می توانند فرایندهای متابولیک زیان آور را متوقف کند تولید می گردند. در همین راستاست که از اثر و خاصیت بازدارنده بعضی از آنتی بیوتیکها در حفاظت مواد غذایی استفاده می شود. یکی از بازدارنده های مهم، بازدارنده تریپسین است که در قسمتهای قبل به آن اشاره شده است. این بازدارنده با ماده پروتئینی یک کمپلکس ناپایدار تشکیل می دهد از این جهت می تواند به سرعت آزاد شود و کار تجزیه پروتئین از این نقطه نظر گرفتار مشکل نشود. اما کمپلکس تریپسین و بازدارنده پایدارتر است از این رو از کارایی تریپسین به شکل مشخص و بسیار مسئله سازی می کاهد.
۴- استفاده از آنزیم به منزله شاخص کارایی فرایندها
از مقاومت حرارتی آنزیمها ممکن است جهت پی بردن به کارایی و یا کامل بودن یک فرایند مورد نظر استفاده شود. مثال مشخص در این رابطه بررسی وجود نسفاتاز قلیایی در شیر پاستوریزه می باشد. عدم وجود این آنزیم دلالت بر خوب، انجام شدن عمل پاستوریزاسیون دارد. چون زمانی که این آنزیم نابود شده باشد، شاخص این است که میکروب سل که میکروبی خطرناک و مقاوم در شیر محسوب می شود نیز از بین رفته است. از پراکسیداز ها و کاتالازها نیز به منزله شاخصی برای نابودی آنزیمهای دیگر استفاده می شود. زیرا اینها دارای مقاومت حرارتی زیاد هستند و نابودی آنها دلالت بر نابود شدن سایر آنزیمها - که بعدا می توانند اثرات نامطلوبی در ماده غذایی به وجود آورند – دارد. پراکسیداز ها، به خصوص پراکسیداز های گیاهی در برابر حرارت بسیار مقاوم هستند به طوری که حتی استفاده از حرارت ۱۲۰ درجه سانتیگراد برای مدت چند دقیقه نمی تواند پراکسیداز های مقاوم را به طور کامل نابود سازد.
در صنایع غذایی مواردی مشاهده می شود که آنزیم غیر فعال شده بار دیگر به صورت فعال در می آید و اثرات مخرب خود را ظاهر می سازد. چنین حالتی در مورد پراکسیداز ها در شیر و سبزیها، کاتالاز در سبزیها و لیپاز در فراورده های لبنی و آنزیمهای تجزیه کننده پروتئین در عصاره مرکبات مشاهده می شود. علت چنین وضعی این است که فرایند حرارتی به کار گرفته شده کافی نبوده است و تغییرات لازم و کافی را روی محل فعال آنزیم به وجود نیاورده است. از این نظر است که علی رغم آنکه پس از پایان یک عملیات حرارتی هیچ فعالیت آنزیمی مشاهده نمی شود، پس از مدتی قسمت محل فعال شکل اولیه خود را به دست می آورد و آنزیم می تواند اثرات بد خود را روی ماده غذایی ظاهر سازد. البته این حالت بازگشت ساختمان طبیعی و اولیه در آنزیمها برخلاف دناتوره شدن آنزیم به کندی و در طول زمان نگهداری ماده غذایی صورت می گیرد. چنین وضعی معمولا وقتی اتفاق می افتد که عمل آنزیم زدایی سریع انجام گرفته باشد.
بتا - آمیلاز غیر احیاء کننده عمل آن وقتی عالی وجود دا مالت جو و گن
۵- بررسی خصوصیات آنزیمهای مختلف آمیلازها آلفا آمیلاز، این آنزیم به میزان وسیعی در گیاهان و حیوانات وجود دارد و هر ملکول آن دارای یک گرم کلسیم می باشد. آلفا آمیلاز آنزیمی است داخلی و به طور تصادفی
باید توجه شو گلوکو آمیلاز گلوکز می باشد با این انجام می دهد. به این ترتیب می تواند ویسکوزیته ایجاد شده توسط محل را کاهش دهد و محیط را رقیق نماید. از همین نظر است که به آن آنزیم ۳۸ نیز گفته می شود. با انجام عمل مالت سازی روی دانه هایی مثل جو می توان این آنزیم را به میزان بسیار زیادی افزایش داد. از چنین مالتی که سرشار از این آنزیم است می توان برای مصارفی چون تولید نان که نیازمند فعالیت آلفا - آمیلاز برای فراهم ساختن قندهای قابل استفاده برای مخمر می باشد، بهره مند شد. البته در مورد گندم، تولید یا وجود آلفا آمیلاز زیاد، نامطلوب است زیرا باعث ایجاد مقادیر زیادی گاز در جریان تولید نان می شود. اما در مورد گندمهایی که مثل گندمهای آمریکای شمالی اساسا دارای آلفا - آمیلاز کمی هستند به کارگیری این آنزیم می تواند سودمند باشد. آلفا - آمیلازی که در صنعت مورد استفاده قرار میگیرد اکثرأ از باسیلوس لی چنی فورمیس یا آسپرژیلوس اریزه ۴۰ به دست می آید.
بتا - آمیلاز. این آنزیم یک آنزیم خارجی یا انتهایی است. به این معنی که از انتهای غیر احیاءکننده نشاسته، ملکولهای گلوکز را به صورت دو تایی یعنی مالتوز جدا می کند. اما عمل آن وقتی که به اتصال می رسد متوقف می گردد. این آنزیم فقط در گیاهان عالی وجود دارد. محصول به دست آمده از آن قابل استفاده برای مخمر است از این نظر از مالت جو و گندم که مقادیر قابل توجهی از این آنزیم را دارند می توان استفاده کرد. در اینجا باید توجه شود که در جریان این تبدیل، شکل آلفا - مالتوز تبدیل به شکل بتا می گردد. کلوگرامیلاز . گلوکو آمیلاز نیزیک آنزیم خارجی است که از انتهای غیر احیاءکننده ملکول، گلوکز را به شکل پی در پی جدا می کند. این آنزیم قادر به شکستن پیوند نیز می باشد با این تفاوت که این کار را نسبت به شکستن پیوند با سرعت کمتری انجام می دهد. از این نظر است که محصول نهایی آن گلوکز می باشد. منابع تولید این آنزیم، اسپرژیلوس نیژر و اسپرژیلوس اریزه هستند. از این آنزیم برای تولید شربت ذرت و گل آن استفاده می شود. یک مشکل که در تبدیل نشاسته ذرت به گلوکز مشاهده می گردی آنزیم ترانس گلوکوزیداز است که در جریان تهيه آلفا آمیلاز و گلوکو آمیلازی می آید. زیرا این آنزیم از گلوکز، اولیگوساکاریدهایی را تولید می کند و از این طرز عملیات را کاهش می دهد. به طور کلی باید توجه داشت که برای آنکه تجزیه نشاسته به خ به شکل کاملی صورت گیرد باید قبلا عمل ژلاتینی شدن آن انجام گرفته باشد. بتا-گالاکتوزیداز. این آنزیم در گیاهان، حیوانات، باکتریها و مخمرها وجود دارد. یکی
کار مهم و مشخص این آنزیم تجزیه لاکتوز است؛ و از همین نظر است که به لاکتاز نیز معروف می باشد. همان طور که قبلا اشاره شد، مصرف شیر به دلیل وجود لاکتوز در آن برای برخی افراد با مسائل گوارشی همراه است. علت این وضع، فقدان همین آنزیم لاکتاز در این افراد می باشد. این آنزیم را می توان از آسپرژیلوس نیژر، آسپرژیلوس اریزه و برخی ساکارومیس ها هم به دست آورد. شکل تثبیت شده آن نیز امروزه به طور موفقیت آمیزی مورد استفاده قرار می گیرد.
پروتئازها
پروتئازها نیز نظیر آمیلازها شامل دو گروه اصلی خارجی و داخلی۴۷ می باشند. انواع خارجی خود دو دسته هستند. یکی کربوکسی پپتیدازها که پیوند پپتیدی اسیدهای آمینه ای را که در انتهای C زنجيره پپتیدی قرار گرفته اند می شکنند و دسته دیگر آمینو پپتیدازها که اسیدهای آمینه موجود در انتهای N را جدا می کنند. پروتئازهای داخلی پیوندهای مختلفی را در داخل زنجيره پپتیدی می شکنند و در این رابطه عملکردی اختصاصی دارند. اینکه کدام پیوند پپتیدی توسط یک آنزیم خاص داخلی شکسته می شود بستگی به گروه R اسیدهای آمینه ای دارد که در طرفین پیوند مربوطه قرار گرفته اند. زیرا برای شکسته شدن پیوند باید اسیدهای آمینه طرفین آن در قسمت محل فعال آنزیم به شکل مناسبی قرار بگیرند تا این عمل انجام شود. از این نظر لازم است که گروههای R این اسیدهای آمینه ، ساختمانی خاصی برخوردار باشند. پروتئازها در فرایندهای متابولیک و در غذایی دارای اهمیت زیادی هستند که در زیر انواع مهمی از آنها مورد بحث قرار صنایع غذایی دارای اهمیت زیا می گیرند. رنين شكل خالص آنزیم موجود در رنت یا مایه پنیر است که در پنیر سازی از آن داده می شود. این آنزیم از معده چهارم گوساله شیرخوار - تا وقتی که از علف تغذیه می کند - استخراج می گردد. پس از آنکه گوساله شروع به مصرف علف می کند به جای رنين پیسین ترشح می شود. این آنزیم به حالت غیر فعال، به نام پرورنین ترشح می گردد. ماده استخراج شده از معده خشک شده، هم دارای رنين و هم دارای پرورنین می باشد. تبدیل پرورنین به رنین با افزودن اسید تسریع می گردد. این فرایند به صورت اتوکاتالیتیک است، یعنی با تولید مقداری رنین، این ماده بقیه پرورنین را به رنین فعال تبدیل می کند. پپسین نیز می تواند کار تبدیل پرورنین به رنین را انجام دهد. عمل تبدیل پرورنین به رنین همراه با آزاد شدن پپتیدهایی از قسمت انتهای N ملکول پرورنین می باشد که طی آن وزن ملکولی از ۳۶۰۰۰ به ۳۱۰۰۰ کاهش می یابد. سه پیوند دی سولفید قسمتهای مختلف پرورین را به هم متصل می کنند که بعد از تبدیل به رنین نیز بدون تغییر باقی می مانند. PH مناسب برای فعالیت ارنین 5/3 است اما بیشترین پایداری آن در PH5 مشاهده می شود. تولید پنیر در PH 5/5-5/6 صورت می گیرد.
انعقاد شیر توسط رنین طی دو مرحله انجام می شود. در مرحله اول که آنزیمی است آنزیم روی کاپا -کازئین که دارای ۱6۹ اسید آمینه می باشد اثر می کند و پیوند میان فنیل الانین و متیونین را که به ترتیب اسیدهای آمینه شماره ۱۰۵ و ۱۰6 در این پروتئین هستند، می شکند. به دنبال این، اثر حفاظت کننده کاپا - کازئین روی کازئین از بین می رود. در مرحله دوم که غیرآنزیمی است، کازئین تغییر یافته، تحت اثر یون کلسیم رسوب می کند. سایر نزیمهای تجزیه کننده پروتئین، نظير پپسین و پروتئازهای میکروبی نیز می توانند همان پیوند ذکر شده را بشکنند. پپسین. پپسین در مخاط پوششی سطح معده تولید می گردد. این آنزیم نیز به صورت غیر فعال موسوم به پپسینوژن ساخته می شود که در PH پایین معده به پپسین فعال تبدیل می گردد این تبدیل هم که اتوکانالیتیک است با جدا شدن چندین پپتید کوچک از قسمت انتهای N ملکول پپسین انجام می گیرد. این پپتیدهای کوچک که به صورت غیر کو الان به پپسینوژن اتصال دارند به منزله یک جلوگیری کننده از فعالیت آن عمل می کنند. اما در PH در معده از پپسینوژن جدا می شوند و پپسین تولید می گردد. پپسین از ۳۲۱ اسید آمینه تشکیل شده است. در تبدیل پسینوژن به پپسین، PH ایزوالکتریک از7/3 به ۱ تنزل پیدا می کند. ساختمان نوع سوم در پپسین به وسیله سه پیوند دی سولفید و یک پیوند فسفاتی پایدار شده است. پپسین در PH بیشتر از ۵ دناتوره می شود و فعالیت خود را از دست می دهد. این آنزیم ترجیحا اتصالهای مجاور فنیل آلانین، تیروزین و تریپتوفان را می شکند. و به طور کلی از بعضی از پروتئازهایی که در PH پایین و اسیدی عمل می کنند (نظیر پپسین) در تولید پنیر استفاده می شود. اما کیفیت پنیر تولیدی به خوبی پنیر تولید شده توسط رنین نیست و پپتیدهای تلخ مزه ای ممکن است تشکیل شوند و مسئله ساز باشند. این گونه پروتئازها همچنین از بعضی میکروارگانیسمها نظیر موکورپوسیلوس به دست می آیند. در زمینه استفاده از پروتئازهای میکروبی در تولید پنیر در سالیان اخیر پیشرفتهای درخور توجهی صورت گرفته است. در تهیه سوس سویا و میزو (غذایی تخمیری از سویا که در شرق آسیا مصرف می شود) نیز از پروتئاز میکروبی (آسپرژیلوس اریزه) استفاده می شود. تریپسین و کیموتریپسین. این دو آنزیم از پانکراس در روده ترشح می شوند. تریپسین پیوند پپتیدی تشکیل شده توسط گروه کربوکسیل اسید آمینه لیزین یا آرژنین با سایر اسیدهای آمینه را می شکند. کیمو تریپسین در واقع شامل چندین نوع آنزیم نسبتا شبیه هم است که با پیشوند آلفا، بتا، گاما، دلتا و پی مشخص می شوند. اینها پیوند مجاور اسیدهای آمینه تیروزین، فنیل آلانین و تریپتوفان را می شکنند و PH مناسب برای فعالیت آنها حدود ۸ می باشد. ین گروه شامل چند نوع آنزیم است که از نقطه نظر تجزیه پروتئینها تفاوتهایی با با یکدیگر دارند. اینها در لیزوزومهای سلولی قرار گرفته اند و از بقیه پروتئازها مثل تریپسین که توسط سلول به خارج ترشح می گردند قابل تشخیص می باشند. این آنزیمها در دوران حیات حیوان نقش چندانی ایفا نمی کنند و می توان گفت حالت مهار شده ای در لیزوزوم دارند. اما پس از مرگ فعالیت مشخصی از خود ظاهر می سازند و همان طور که در مبحث پروتئین اشاره شد در عمل ترد شدن گوشت بعد از کشتار و جمود نعشی شرکت می کنند. این آنزیمها احتمالا بعد از مرگ از لیزوزومها رها می شوند و باعث تجزیه میوفیبریلها در داخل سلول ماهیچه و همین طور پروتئین بافتهای پیوندی (نظیر کولاژن) می گردند. پاپائین ۷ه، فيسينه
و بروملائين ۵۹. این آنزیمها دارای ریشه گیاهی هستند و به ترتیب از میوه درخت پاپایا ( که کاملا رسیده نباشد)، از لاتكس " انجیر (شیره سفیدرنگ مترشحه از درخت) و از میوه و ساقه درخت آناناس به دست می آیند. محل فعال این آنزیمها دارای یک سیستئین و یک هیستیدین است که برای فعالیت آنها ضروری می باشند. PII مناسب برای اینها
۷ / ۵ - ۱ است. این آنزیمها پیوندهای پپتیدی، استری و آمیدی را هیدرولیز می کنند. پاپائین از یک زنجیره واحد پلی پپتیدی با ۲۱۲ اسید آمینه تشکیل شده است. عمل کاتالیزوری این آنزیم در دو مرحله صورت می گیرد. در مرحله اول آسیله شدن که طی آن یک ترکیب حد واسط آنزیم - اسیل تولید می گردد.
- رنگهای تأیید شده
رنگهای مورد مصرف در مواد غذایی را می توان به دو گروه تقسیم کرد. گروه اول رنگهای طبیعی هستند که ممکن است از منابع طبیعی به دست آیند و یا اینکه همین مواد از طریق سنتز ساخته و تهیه شوند. تمام مواد رنگی که تا کنون مورد بحث قرار گرفتند. جزء این گروه از رنگها می باشند. به طور کلی افزودن این نو و مواد رنگی به مواد و محصولات غذایی کاملا مجاز و آزاد است از این نظر اینها را رنگهای بنا به تایید می نامند. در جا۔ ول ۳ این رنگها و موارد محدودیت مصرف آنها مشخص گرد یاه است. باید توجه شود که اگرچه در اکثر موارد محدودیت قانونی برای مصرف این مواد وجود ندارد، اما مسئله قیمت زیاد و یا به وجود آمدن طوسی خاص در ماده غذایی، عملا مصرف برخی از آنها را محدود می کند.
گروه دوم شامل آن دسته از مواد رنگی است که در طبیعت وجود ندارند. اما از طریق سنتز ساخته می شوند. مصرف این گروه از مواد نیازمند تأیید ارگانها و قوانین بهداشتی ذی ربطی است. از این جهت این دسته از مواد، رنگهای نیازمند به تأیید یا به عبارتی ساده تر، رنگهای تایید شده نامیده می شوند. سابقه تولید و مصرف این رنگها به اواسط قرن گذشته باز می گردد. ماده مورد استفاده برای تولید اینها قطران زغال سنگ است و به دلیل قدرت ایجاد رنگ زیاد، مصرف آنها به سرعت گسترش یافت و جایگزین رنگهای طبیعی مورد مصرف گردید. به طوری که در آغاز قرن حاضر حدود ۷۰۰ نوع مختلف از این گروه رنگها در بازار آمریکا وجود داشت. در طول دهه های گذشته به جهت آنکه بررسیهای گسترده انجام شده، بروز خطرات بالقوه ای برای سلامت و به خصوص ایجاد بیماری سرطان در حیوانات آزمایشگاهی را نشان داد، مصرف بخش اعظم این رنگها در مواد غذایی غیرمجاز اعلام
گردید. ساختمان شیمیایی رنگهای تأیید شده برای مصارف غذایی در امریکا در شكل ۱۷ مشخص شده است. اگر چه امروزه صنعت پتروشیمی مواد اولیه لازم برای تولید رنگهای تأیید شده را فراهم می کند. ولی باز به دلیل زمینه تاریخی که در بالا اشاره شد هنوز از این رنگها اکثرا تحت عنوان رنگهای قطران زغال سنگ یاد می شود که صحیح نمی باشد.
منابع
شیمی مواد غذایی ، دکتر حسن فاطمی
- سرویس دهندهگروه دانش صنایع غذایی بندر
- تاریختیر 1399
- دسته بندی اخبار و مقالات
- لینک منبعwww.BandrFood..ir
- اشتراک >




