
آب
آب
اساسا بخش مهمی از بسیاری از اقلام غذایی را آب تشکیل می دهد. به علاوه آب دارای ویژگیهای خاص و کم نظیری است که شرایط و عملکردهای مخصوصی را در سیستمهای غذایی به وجود می آورد. آگاهی از این ویژگیها به خصوص در صنایع غذایی دارای اهمیت بسیار زیادی می باشد.
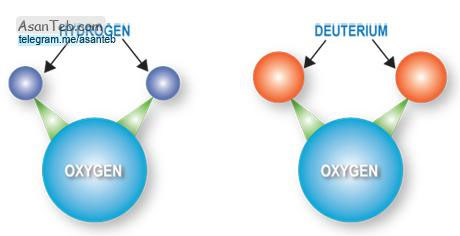
١ - ساختمان آب
ملکول آب از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده است. اما وضع قرار گرفتن اتمهای هیدروژن نسبت به اکسیژن به گونه ای است که این اتمها با یکدیگر زاویه ای برابر ۱۰۵ درجه می سازند. از این نظر ملکول آب از نظر الکتریکی حالت متعادلی نداشته یعنی در طرف اتم اکسیژن بار منفی و در طرفی که اتمهای هیدروژن قرار گرفته اند مقداری بار مثبت وجود دارد. نتیجه آنکه ملکول آب ترکیبی قطبی است و در رابطه با مواد قطبی و غیر قطبی عملکردی متناسب با این ویژگی از خود ظاهر می سازد.
بی تردید این ویژگی قطبی بودن، بر خود ملکولهای آب نیز تأثیر می گذارد و بین آنها ارتباط با پیوندهایی که پیوند هیدروژنی نامیده می شوند به وجود می آورد. یک ملکول آب را می توان چنین در نظر گرفت که در مرکز یک چهار وجهی منظم قرار گرفته است. در این حالت مطابق اکسیژن می تواند با دو ملکول آب و هر هیدروژن با یک ملکول آب پیوند هیدروژنی برقرار نماید. به این ترتیب هر پنج ملکول آب با یکدیگر تجمع می یابند و خصوصیات ویژه آب را به وجود می آورند.
برای توجه بیشتر به این خصوصیات آب کافی است که آب را با موادی که دارای ملکولهای مشابهی هستند - مثل آمونیاک و متان - مقایسه کرد. مثلا در حالی که آب در شرایط عادی، مایع و دارای نقطه تبخیر بالا یعنی ۱۰۰ درجه سانتیگراد است، ترکیبات باد
شیمی مواد غذایی سانتیگراد، پیوسته از حجم آن کاسته می شود. اما با کاهش درجه حرارت آب از ۴ به صفر دلیل تشکیل نوع متفاوتی از پیوندهای هیدروژنی میان ملکولها، مقداری بر حجم آب افزود می گردد. با انجماد آب، افزایش حجم به طور چشمگیری یعنی به میزان حجم آب صورت می گیرد. در این حالت پیوندهای هیدروژنی موجود از میان رفته و پیوندهای جدیدی که هر چهار ملکول آب را به هم متصل می کند تشکیل می شود. در هنگام تبخیر آب نیز پیوندهای هیدروژنی از بین می روند. گذشته از حرارت، یونها (یا مواد قابل یونیزه شدن) و همچنین ترکیباتی که توانایی ایجاد پیوند هیدروژنی دارند بر ساختمان طبیعی آب و پیوندهای موجود در آن اثر می گذارند و سبب تغییر آنها و تشکیل شکل جدیدی از پیوندها می شوند. به دلیل همین تغییر است که در صورت وجود چنین مواد و ترکیباتی در آب، عمل سرد کردن آب باید تا زیر صفر سانتیگراد انجام شود تا انجماد آن صورت گیرد.
یونهای معدنی که مثلا از تجزیه نمک طعام حاصل می شوند قادر به ایجاد پیوند هیدروژنی نیستند و صرفا به کمک نوع بار خود قسمت خاصی از ملکول آب را به طرف خود جذب می کنند. اگرچه در محلولهای رقیق نمک فقط لایه های آب اطراف يون گرفتار تغيير ساختمانی می شوند و توده اصلی آب بی تغییر باقی می ماند، اما در محلولهای غلیظ نمک ساختمان این آب نیز دستخوش تغییر می شود. طبق شواهد موجود برخی از یونها به گونه ای سبب تغییر در ساختمان آب می شوند که در اثر آن محلول حاصله دارای سیالیتی کمتر از آب خالص می گردد. یونهای دارای میدان الکتریکی قوی نظیر سدیم، کلسیم و آلومینیم می توانند چنین حالتی را ایجاد کنند. اما گروه دیگری از یونها باعث افزایش سیالیت آب می شوند. یونهای دارای میدان الکتریکی ضعیف مثل پتاسيم، آمونيم و كلر جزء این گروه هستند.این یونها در حالی که ساختمان اولیه آب را تغییر می دهند، برخلاف یونهای گروه اول آنقدر توانایی ندارند که ساختمان مستحکم جدیدی برای آن فراهم کنند.
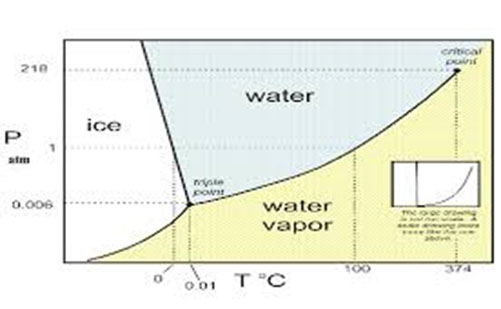
۲ - نمودار فازهای آب
رابطه میان حالات مختلف آب، یعنی مایع، جامد و بخار در بسیاری از فرایندهای غذایی نظیر تغلیظ کردن، خشک کردن، انجماد، خشک کردن در انجماد و سرد کردن تحت خط بسیار حائز اهمیت است. این رابطه را می توان از روی نمودار فازهای آب تشخیص داد.
یک فاز را می توان برحسب یک حالت یکنواخت و مشخص فیزیکی در یک سیستم معین و مشخس نمود که بر حسب همین حالت از فمنها با فازهای دیگر سیستم به وسیله یک مرز معین که معمولا نامرئی نیز می باشد جدا و مشخص می گردد. نموداری که بیان کننده تعادل میان فازهای مختلف باشد، نمودار فازی نامیده می شود. یک نمودار فازی، ارتباط حالات مختلف ماده را از نقطه نظر حرارت و فشار نشان می دهد.
شرایط تعادل در درجه حرارت و فشارهای مختلف برای فازهای مایع و بخار توسط منحنی AO ، برای فازهای جامد و بخار به وسیله منحنی BO و برای فازهای جامد و مایع توسط منحنی CO مشخص می گردد. منحنی AO گاهی منحنی (فشار - بخار) یا نقطه جوش نامیده می شود. BO منحنی تصعید و CO منحنی ذوب می باشند.
نقطه به نشان دهنده درجه حرارت بحرانی است (درجه حرارتی که در بالاتر از آن دیگر تحت هیچ فشاری یک گاز به مایع تبدیل نمی گردد. برای آب این حرارت ۳۷۴ درجه سانتیگراد است که در بالاتر از آن فازهای مایع و بخار از یکدیگر غیر قابل تشخیص هستند. برای انجام تصعيد، فشار باید کمتر از 579/4 میلیمتر جیوه و درجه حرارت کمتر از صفر سانتیگراد باشد.
منحنی ذوب کمی به طرف چپ متمایل است. این نشان میدهد که افزایش فشار منجر به پایین آمدن نقطه ذوب می گردد. علت این امر این است که یخ دارای فشردگی کمتری نسبت به آب می باشد.
DO نشان دهنده فشار بخار آب فراسرد است. نکته جالب این است که این آب دارای فشار بیشتری نسبت به یخ می باشد (در درجه حرارت معین). آب فراسرد از نظر ترمودینامیکی ناپایدار است و اگر تکه کوچکی از یخ بدان افزوده شود تبدیل به یخ می گردد.
محل تقاطع کلیه خطوط، نقطه 0 است که شرایط حرارتی و فشاری آن به ترتیب
0099/0 درجه سانتیگراد و 579/4 میلیمتر جیوه می باشد. این نقطه به عنوان نقطه سه گانه ۵ شناخته می شود و مشخص کننده نقطه ای است که تمام فازها در آن در حالت تعادل هستند. بالاتر بودن نقطه انجماد (به میزان کم) نسبت به حد طبیعی که صفر است ناشی از دو اثر کم بودن فشار می باشد. این در اثر عبارتند از:
1- ساختمان باز یخی به سادگی در فشارهای پایین حفظ میگردد. ۲- تمام گازهای محلول برداشته می شوند.
باید توجه شود که این منحنیها در مورد آب خالص است. طبیعتا در مورد محلولهای غذایی، انحرافها یا تفاوتهایی در وضعیت این خطوط وجود دارد. اما بسیاری از این انحرافها
- آب در رابطه با ذرات کلوئیدی
بخش مهمی از سیستمهای غذایی به صورت کلوئیدی هستند و وضعیت و ارتباط آب با ذرات کلوئیدی در این سیستمها در خور تأمل و حائز اهمیت می باشد. به طور کلی تحت این شرایط آب به سه صورت وجود دارد:
الف - لایه جذبی
این لایه به شکل محکمی به ذره کلوئیدی چسبیده است و تحت اثر نیروی میدان ملکولی قرار دارد. به این آب، آب متصل گفته می شود. از خصوصیات آن این است که تحت فشار بوده، چگالی آن زیاد است، قادر به حل نمکها نیست و به سادگی تبخیر نمی گردد. همچنین در حرارتهای عادی انجماد، منجمد نمی گردد و در هیچ حرارتی تبدیل به کریستال نمی شود.
ب - لایه منتشره
این لایه دارای قدرت اتصال کمتری بوده و به شکل ضعیفتری به لایه جذبی متصل شده است. این لایه هنوز به صورت آب آزاد نیست. در واقع این لایه حالت یکنواخت ندارد و هر چه از لایه جذبی دور می شود آب شکل حقیقی تری به خود می گیرد. البته تغییر حالت آب در مورد تمام لایه های آن دارای حد و مرز مشخص و ناگهانی نمی باشد. ضخامت لایه جذبی حدود ۲ آنگستروم و ضخامت لایه منتشر تا ۸۰۰ آنگستروم است.
ج - لایه آب آزاده
این آب دارای تمام خصوصیات آب معمولی می باشد. بافتهایی که دارای مقدار زیادی آب متصل هستند نسبت به بافتهایی که دارای مقادیر کمتری از این آب می باشند در هنگام خروج از حالت انجماد گرفتار صدمات کمتری می گردند. به علاوه این آب تأثیر خاصی روی واکنشهای زمان انجماد دارد و فاکتور مهمی در جلوگیری از تشکیل کریستال محسوب می شود.
میزان آب غیر قابل انجماد (برحسب میزان پروتئین موجود که نقش مهمی در جذب آب دارد) از یک ماده به ماده دیگر فرق می کند. برای بافتهای حیوانی ۱۰ - ۸ درصد پیشنهاد شده است؛ در برخی از سبزیها کمتر از 6 درصد و در دانه کامل ذرت ۳۴ درصد می باشد.

۴- فعالیت آب
فساد ماده غذایی هنگام نگهداری در انبار می تواند به سرعت توسط میکروارگانیسمها انجام گیرد، در حالی که واکنشهای آنزیمی و شیمیایی به شکل آهسته تری صورت میگیرد. در هر دو مورد آب مهمترین عامل در کنترل این فادها می باشد. میزان محتوای آب یک ماده غذایی ممکن است بر پایه وزن مرطوب و یا وزن خشکی آن گزارش شود. از نقطه نظر محاسبه برای فرآیندها، وزن خشک بیشتر در نظر گرفته می شود در حالی که در جداول غذایی، وزن مرطوب ماده غذایی درج و مورد نظر قرار میگیرد. البته صرفأ میزان آب یک ماده غذایی نمی تواند ملاک سنجش فساد قرار گیرد. زیرا مثلا روغن بادام زمینی در رطوبت بیش از 9/0 درصد رو به فساد می گذارد؛ در صورتی که نشاسته سیب زمینی در رطوبت ۲۰ درصد هنوز پایدار است. بنابراین در اینجا موضوع موجودیت یا در دسترس بودن آب مطرح خواهد بود که این موجودیت تحت عنوان فعالیت آب (aw) مورد بررسی قرار می گیرد. برخی از فرآیندها از طریق حذف رطوبت از ماده غذایی بر این موجودیت اثر می گذارند که اینها عبارتند از خشک کردن، خشک کردن در حالت انجماد، تبخیر و تغليظ از طریق انجماد. اما بعضی دیگر با بی حرکت یا تثبیت کردن آب این کار را انجام می دهند. اینها شامل استفاده از مواد جاذب الرطوبه مثل قند انورت (در مواد غذایی با رطوبت متوسط) و تبدیل شیمی مواد غذایی آب به کریستالهای یخی از طریق انجماد می باشند. پس به طور خلاصه دو نوع فرآیند مطرح است، یکی حذف آب و دیگری تثبیت آب.
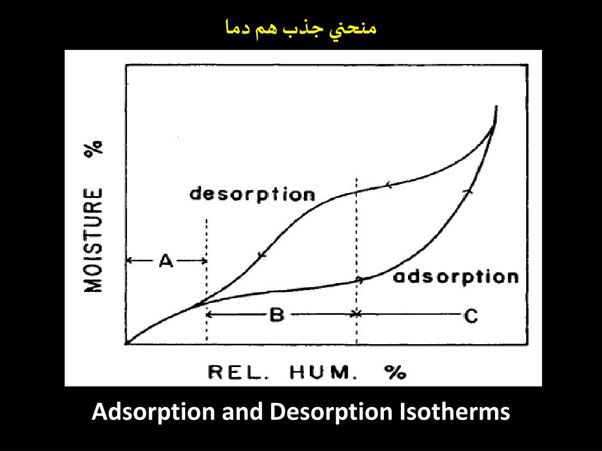
آب موجود در ماده غذایی دارای یک فشار بخار است که میزان آب بستگی دارد به: ا- میزان آب موجود، ۲- درجه حرارت و ۳ - غلظت مواد محلول (به خصوص نمکها و قندها) در آب طبق تعريف، فعالیت آب عبارت است از نسبت فشار بخار آب در ماده غذایی به فشار بخار اشباع شده آب در همان درجه حرارت موادی اتفاق می افتد که میزان فعالیت آب در آنها بیشتر از ۳/ ۰ - ۲/ ۰ باشد. منحنی بسته ای که به این ترتیب به وجود می آید سیکل یا حلقه هیترسیس نامیده می شود. پدیده هیسترسیس می تواند به دلایل زیر باشد:
ا- در طول جدا کردن آب از ماده غذایی میان اجزاء جامد آن فعل و انفعالاتی انجام می گیرد به طوری که برخی از نقاط جذب کننده آب به شکل غیرقابل برگشتی از دست می روند.
۲ - وجود اختلاف در فشار بخار آب لازم برای پر کردن و خالی کردن فضاهای موئین با ساختمانی نامنظم از آب.
نظر به اینکه در یک میزان فعالیت آب یکان، نمونه های ماده غذایی در جریان جذب آب مجدد نسبت به زمان از دست دادن آب دارای مقدار آب کمتری هستند بنابراین اویسکوزیته آنها بیشتر خواهد بود. یکی از نتایج چنین حالتی می تواند این باشد که در عمل
جذب آب مجدد در مقایسه با جریان از دست دادن آب (در یک فعالیت آب معين) میزان اکسیداسیون کمتر باشد.
به طور کلی موادی که به سهولت جذب رطوبت می کنند نسبت به مواد دیگر منحنی جذب هم دمای پرشیب تری دارند. در مورد بسیاری از مواد غذایی، قسمت اول منحنی جذب هر دما کاملا صاف است که دلالت بر پایین بودن تمایل ماده غذایی به جذب آب دارد. اما قسمت بعد منحنی شکل کاملا شیب داری داشته که نشان دهنده سهولت جذب رطوبت در این قسمت می باشد. چنین منحنیهایی خاص آن دسته از مواد غذایی است که دارای مقادیر زیادی شکر یا نمک هستند و توانایی جذب آب کمی در شبکه موئین خود دارند.
مواد نشاسته ای مثل گندم و برنج نسبت به مواد پروتئینی نظیر گوشت، در فعالیت آب پایین، آب بیشتری جذب می کنند. به طور کلی قندها به منزله یک گروه واحد دو نوع منحنی جذب هم دما نشان می دهند. در حالت بی شکل یا آمورف، نیا به سهولت جذب رطوبت می کنند. در صورتی که در حالت کریستالی چنین خصوصیتی را به میزان کمی نشان می دهند. در اینجا یک مشکل می تواند به دلیل تغییر حالت از بی شکل به کریستالی ظاهر شود که با آزاد شدن آب همراه است. در چنین موردی اگر نند به منزله جزئی در یک سیستم غذایی باشد، در این صورت مواد دیگر موجود در سینم، آب را جذب می کنند که این حالت معمولا با تغییرات شیمیایی و فیزیکی همراه است.
اثر عملیاتی چون حرارت دادن ماده غذایی روی رفتار جذبی و بالطبع شکل منحنی جذب هم دمای آن می تواند بیشتر از وقتی باشد که ماده ای با قدرت جذب آب کمتر یا بیشتر به آن اضافه شود. به طور کلی در اثر حرارت، قدرت جذب آب مواد پروتئینی کاهش می یابد. زیرا تعداد نشاط فعال آنها در چنین فرآیندی به دلیل انجام دناتوره شدن کم می شود
عملیات دیگری نظیر نمک زدایی و تغيير PH نیز دارای چنین اثری می باشند). پوشاندن سطح ماده جذب کننده رطوبت با چربی نیز تعداد نقاط فعال را کاهش می دهد.
به کار گرفتن مواد جذب کننده رطوبت در مواد غذایی سبب می شود تا بدون کاهش آب میزان فعالیت آب در آنها کم شود. موادی مثل نمک، قند، گلیسرول و پروپلین گلیکول ۲۵ می توانند این کار را انجام دهند. این مواد به خصوص در مورد آن دسته از مواد غذایی که رطوبت آنها ۳۵ - ۱۵ درصد و فعاليت آب آنها است و همچنین موادی که باید برای مدتی طولانی نگهداری شوند (مثل یكوينها) مورد استفاده قرار می گیرند.
به طور کلی عمل جذب آب و اثر آن بر خصوصیات فیزیکی ماده غذایی می تواند به سه صورت باشد:
1- جذب بدون تغيير ساختمانی در ماده جذب کننده مثل جذب سطحی توسط کریستال قند
۲ - جذب همراه با تغییر ساختمانی در ماده جذب کننده مثل شیر و سفیده تخم مرغ. ٣- جذب همراه با تشکیل یک محلول مثل محلولهای قندی.
فعالیت آب و پایداری ماده غذایی تقریبا تمام فعالیتهای میکربی در کمتر از aw=0/6متوقف می شوند. این رقم برای اکثر کیکها کمتر از 7/0 ، مخمرها کمتر از 8/0 و باکتریها کمتر از 9/0 می باشد. اثر متقابل فعالیت آب با درجه حرارت، PH ، اکسیژن، دی اکسیدکربن و یا مواد حفاظت کننده شیمیایی، دارای نقش مهمی در جلوگیری از رشد میکربها می باشد. هرگاه یکی از شرایط محیطی (غیر از فعالیت آب) در مورد یک میکروارگانیسم مشخص در حد اپتیمم نباشد، در این صورت اثر
کاستن از میزان فعاليت آب موجود بر روی میکروارگانیم افزایش می یابد. این باعث می شود که از طریق ترکیب چند مکانیزم کنترل کننده ملایم، به حفظ ماده غذایی به صورتی دست یافت که یک کاهش چشمگیر و اساسی در خصوصیات حسی و تغذیه ای آن را به همراه نداشته باشد.
فعالیتهای آنزیمی در حقیقت در مقادیر به کمتر از مقدار تک لایه BET متوقف می شوند. علت این امر تحرک کم سوبسترا و عدم توانایی آن در نفوذ به نقطه فعال روی آنزیم می باشد. تغییرات شیمیایی، پیچیدگی بیشتری دارند. دو نوع از اینها که بیشتر در مواد غذایی در مقدار به پایین به وقوع می پیوندند، قهوه ای شدن میلارد و اکسیداسیون چربیها می باشند.
مقدار بود که سبب حداکثر میزان قهوه ای شدن در مواد غذایی می شود به نوع ماده غذایی بستگی دارد. اما به طور کلی در بة پایین، تحرك موادی که وارد واکنش می شوند کم است که کاهش قهوه ای شدن را به همراه دارد. معمولا حداکثر قهوه ای شدن در فعالیت آی تین 6/0 تا ، صورت می گیرد. از نقطه نظر گروههای مواد غذایی، موادی با رطوبت متوسط (رطوبتی برابر ۴۰-۲۰ درصد) نظير کيکها، خرما و بعضی بنیرها حداکثر این واکنش را در خود نشان می دهند. در مقادیر رطوبت زیاد به دلیل رفت مواد واکنش کننده میزان قهوه ای شدن کاهش منزله یک عامل جلوگیری کننده از ادامه واکنش به وجود آورنده آن عمل کند.
اکسیداسیون چربیها در مقادیر پایین به صورت میگیرد که این به دلیل عمل رادیکالهای آزاد می باشد. در بالاتر از مقدار آب تک لایه BET ، آنتی اکسیدانها و عوامل تشکیل دهنده کمپلکس با فلزات، محلول می گردند و میزان اکسیداسیون را کاهش می دهند. در مقادیر بیشتر، فعالیت کاتالیزوری فلزات به دلیل جذب آب و تشکیل هیدروکسیدهای نامحلول کاهش می یابد. اما در مقادیر زیاد با کاتالیزورهای فلزی محلول میگردد و ساختمان ماده غذایی متورم می شود که در حالت اخیر نقاط فعال زیاد تر دارای قابلیت واکنش در رو و در معرض انجام واکنش قرار می گیرند. اثر میزان فعالیت آب را روی عواملی که باعث فساد و تغییرات نامطلوب در مواد غذایی می شوند نشان میدهد.
اکثر آنزیمها در فعالیت آب کمتر از ۸۵/ . بی اثر هستند. اما لازها ۲۸ تا فعالیت آب 3/0 یا حتی 1/0 می توانند فعال باشند. جداسازی آنزیم از سوبسترا به میزان زیاد از چنین واکنشهای نامطلوبی جلوگیری می کند. چنانچه سوبسترا به صورت مایع باشد، بسیار سریعتر تحت اثر آنزیم قرار می گیرد. مثلا هیدرولیز روغن مایع در فعالیت آبی معادل ۱۵/0 مشاهده گردیده، در صورتی که روغن جامد در چنین شرایطی به میزان ناچیز گرفتار هیدرولیز می شود.
اکسیداسیون چربیها در رابطه با میزان فعالیت آب همانطور که قبلا اشاره شد پیچیده می باشد. به نظر می رسد نگهداری مواد خشک شده و خشک شده در حالت انجماد در رطوبتی بالاتر از مقدار رطوبت تک لایه ای که سطح اجزاء را می پوشاند حداکثر حفاظت در برابر اکسیداسیون را فراهم نماید. مطالعات انجام شده در مورد اکسیداسیون در ماهی سالمون خشک شده در حالت انجماد نشان داده که اکسیداسیون چربیها با افزایش میزان آب ماهی کاهش یافته است. البته در مورد مواد غذایی چون اجزاء و انواع واکنشهای مختلف می توانند مطرح باشند باید در مجموع میزان فعالیت آب (یا درصد رطوبت مناسبی را به دست آورد که در آن حداقل واکنشهای نامطلوب صورت بگیرد.
فعالیت آب و بسته بندی
بسته بندی مواد از نقطه نظر بسیار مهم است. منحنی جذب هم دما نقش مهمی در انتخاب مواد بسته بندی ایفا می کند. موادی که به سهولت جذب رطوبت می کنند همیشه دارای منحنی شیب دار بوده و قبل از آنکه به یک رطوبت متعادل با محیط خارج برسند به یک سطح بحرانی و مشکل آفرین از رطوبت رسیده اند. این گونه مواد باید در ظروف شیشه ای که در مقابل نفوذ رطوبت مقاوم باشند یا بسته های پلاستیکی با همین خصوصیت (نظیر پلی وینیل کلرید ۲۲ Pvc) نگهداری شوند. یک مثال در این مورد قهوه فوری است که تحت رطوبت نسبی ۵۰ درصد، میزان رطوبت آن به یک حد بحرانی می رسد. تحت چنین شرایطی محصول حالت چسبنده و کلوخه ای شکل به خود می گیرد و یک ویژگی لازم، یعنی حالت سیلان و جریان یافتن خود را از دست می دهد. فرآورده های دیگری که به سهولت جذب رطوبت نمی کنند، می توانند در ظروف و مواد پلی اتیلنی ۳۵ بسته بندی شوند. در مورد بعضی مواد که رطوبت نسبی متعادل برای آنها بیش از رطوبت محیط اطرافشان است (مثل کیک و انواعی از پنیر) کار بسته بندی نقش جلوگیری کننده در از دست رفتن رطوبت را ایفا می کند.
در تهیه مخلوطهای مختلف خشک غذایی نظیر سوپهای خشک که از اجزاء مختلفی ممکن است پس از بسته بندی از جهت رطوبتی مشکل ایجاد شود. این مشکل زمانی به وجود می آید که هر یک از اجزاء در یک میزان رطوبت خاص و متفاوتی قبلا با محیط اطراف خود به تعادل رسیده باشند. قرار گرفتن این اجزاء در درون یک بسته واحد و فاقد تبادل با محیط خارج سبب می شود که میان آنها تبادل رطوبتی صورت گیرد که این عمل ممکن است برای یک جزء و یا بیشتر زیان بار باشد و به کاهش کیفیت یا حتی فساد ماده داخل بسته بیانجامد. از این نظر لازم است قبل از قرار دادن چنین اجزایی در داخل یک بسته واحد میزان رطوبت آنها در یک حد مناسب تعدیل و تنظیم گردد تا بعدا مشکل مزبور به وجود نیاید.
منابع
شیمی مواد غذایی ، دکتر حسن فاطمی
- سرویس دهندهگروه دانش صنایع غذایی بندر
- تاریختیر 1399
- دسته بندی اخبار و مقالات
- لینک منبعwww.BandrFood..ir
- اشتراک




