پروتئین ها
1- پروتئین ها
پروتئین ها پلیمری از اسیدهای آمینه هستند که به دلیلی ساختمان و ترکیب شیمیایی خاص خود نقش مهمی در ایجاد در خصوصیات فیزیکی و بافتی غذا و ایجاد عطر و طعم در غذا حائز اهمیت میباشند. از نقطه نظر بیولوژیک نیز با تأمین آمینواسیدهای ضروری به بدن در ساخت پروتئین های و آنزیمها و بسیاری از هورمونهای کمک میکنند.
1.1 – اسیدهای آمینه
باتوجه به اینکه آمینواسیدهای زیادی در طبیعت وجود دارند اما فقط 20 نوع از آنها در ساختمان پروتئین ها دخالت دارند شکل ساختمانی آمینواسیدها در زیر نشان داده شده است.
زنجیره جانبی R مشخص کننده نوع آمینواسید میباشد و ویژگیهای منحصر به فرد هر آمینواسیدی مربوط به این زنجیره است. بر اساس نوع زنجیره جانبی آمینواسید ها را به 4 گروه تقسیم میکنند:
- – اسیدهای آمینه با زنجیره غیر قطبی و غیر باردار مثل : آلانین، لوسین، ایزولوسین، متیونین، فنیل آلانین، پرولین، و والین
- – اسیدهای آمینه با زنجیره جانبی قطبی و غیر باردار مثل: سرین ، ترئونین، تیروزین و سیستئین. این آمینواسید ها میتوانند از طریق پیوندهای هیدروژنی با دیگر آمینواسید ها پیوند برقرار کنند.
- – اسیدهای آمینه با زنجیره جانبی با باز مثبت مانند لیزین، آرژینین و هیستیدین
- –اسیدهای آمینه با زنجیره جانبی با باز منفی مانند گلوتامیک اسید و آسپارتیک اسید
نوع دیگری از طبقه بندی اسیدهای آمینه از نظر بیولوژیک میباشد که آمینواسیدها به دو دسته ضروری و غیر ضروری تقسیم میشوند. اسیدهای آمینه ضروری در بدن ساخته نمیشوند و باید از طریق رژیم غذایی دریافت شوند که عبارتند از : والین، لوسین، ایزولوسین، ترئونین، فنیل آلانین، تریپتوفان، متیونین و لیزین . همچنین هیستیدین برای نوزاد انسان و آرژینین برای نوزاد حیوانات ضروری میباشد.
اسیدهای آمینه طبیعی از نظر ساختمان فضایی به صورت L میباشند. تمام اسیدهای آمینه به جز گلایسین که گروه R ان هیدروژن میباشد، دارای کربن نامتقارن بوده، بنابراین نور پلاریزه را منحرف کرده و اصطلاحاً فعال نوری میباشند.
اسیدهای آمینه به دلیل داشتن گروههای کربوکسیل و امین میتوانند بر حسب PH به صورت کاتیون ،آنیون و یا یون دوجنسی (زویتر یون) وجود داشته باشند .
آمینواسید ها در محیط اسیدی (غلظت بالای یون هیدروژن) به صورت کاتیون، و در محیط قلیایی به صورت آنیون میباشند. در یک PH خاص هر دو گروه امین و کربوکسیل به ترتیب دارای باز مثبت و منفی هستند و بنابراین مولکول دارای بار خالص صفر میباشد. به این PH، نقطه ایزوالکتریک یا PH می گویند )یون دو جنسی( .آمینواسید های دارای یک گروه کربوکسیل و یک گروه امین PH برابر 5/5-6 دارند.
1.2 – پروتئین ها
از میانکنش گروه امین یک آمینواسید با گروه کربوکسیل آمینواسید ماقبل آن یک پیوند تشکیل میشود که به ان پیوند پپتیدی می گویند. حاصل این واکنش یک دی پپتید میباشد. با تجمع تعداد بیشتر آمینواسید ها توسط پیوندهای پپتیدی ،اولیگوپپتید و سپس پلی پپتید به وجود می آید. هنگامی که در زنجیره پلی پپتیدی تعداد آمینواسید ها بیشتر از 100 باشد به ان پروتئین می گویند.
پروتئین ها به دو گروه ساده و مرکب تقسیم بندی میشوند. پروتئین های ساده ،پروتئین هایی هستند که فقط از آمینواسید تشکیل یافته است و در اثر تجزیه ان فقط آمینواسید بدست می آید .پروتئین های مرکب علاوه بر واحدهای آمینواسیدی دارای قطعاتی حاوی اسیدهای نوکلئیک (نوکلئوپروتئین ها(، کربوهیدرات) گلیکوپروتئین ها( و چربی) لیپوپروتئین ها) باشد.
پروتئین ها را میتوان بر اساس حلالیتشان نیز تقسیم
بندی کرد. از این نظر پروتئین ها شامل:
آلبومین: محلول در آب و حساس به حرارت گلوبولین: محلول در حلالهای نمکی ضعیف گلوتلین ها: محلول در 70% الکل
گلوتلین ها: محلول در محلولهای اسیدی و بازی رقیق و نیز پرولامین ها، اسکلروپروتئین ها، پروتامین ها و هیستیدین ها میباشد.
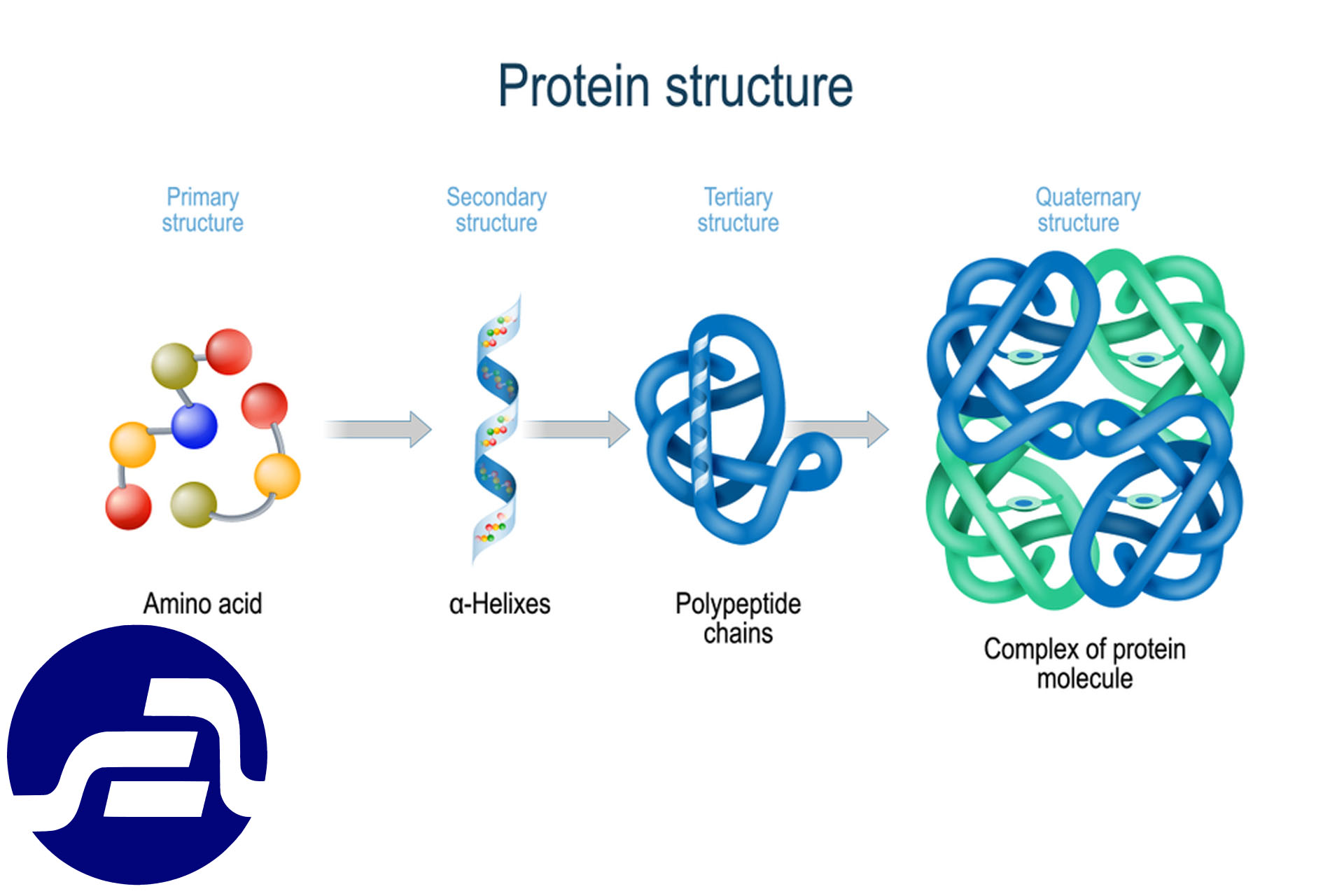
1.2.1 – ساختمان پروتئین ها
ساختمان نوع اول: این ساختمان از به هم پیوستن آمینواسید ها به وجود آمده و در واقع مشخص کننده ترتیب قرار گیری آمینواسید ها میباشد. ساختمانهای نوع اول تعیین کننده ساختمانهای بعدی پروتئین نیز میباشد. برای نوشتن ترتیب آمینواسیدها از سه حرف نام اول هر آمینواسید استفاده می گردد HZN-VAL- PRO- ALA-COOH و ترتیب آمینواسید ها به شکلی نوشته میشود که آمینواسید انتهای (Nامین) در سمت چپ قرار گیرد.
در این زنجیره پپتیدی نشان داده شده،( والین val )آمینواسید انتهای N میباشد.Ala نیز آمینواسید انتهای C (کربوکسیل) میباشد.
![]() آمینواسید انتهای N را میتوان با واکنش سانگر یا استفاده از
آنزیم آمینوپپتیداز تعیین کرد .آمینواسید انتهای C ر ا نیز میتوان از واکنش
پروتئین با هیدرازین و یا اثر آنزیم کربوکسی پپتیداز که آمینواسید انتهای C
را جدا میکند.
آمینواسید انتهای N را میتوان با واکنش سانگر یا استفاده از
آنزیم آمینوپپتیداز تعیین کرد .آمینواسید انتهای C ر ا نیز میتوان از واکنش
پروتئین با هیدرازین و یا اثر آنزیم کربوکسی پپتیداز که آمینواسید انتهای C
را جدا میکند.
مشخص کرد .کاملترین روش برای تعیین
توالی آمینواسیدها، روش تجزیه ادمن میباشد. در این روش اسیدامینه انتهای N
پروتئین با فنیل ایزوتیوسیانات واکنش داده و تولید N– فنیل
تیوکابامویل پپتید میکند. سپس این کمپلکس تحت اثر اسید کلریدریک شکسته شده و
آمینواسید انتها N به صورت یک ترکیب حلقوی جداسازی شده که ان را با روشهای
مخصوصی شناسایی میکنند.
پیوند پپتیدی به صورت ترانس میباشد. این پیوند حالت رزونانس داشته ) NH – CO( و بنابراین یک پیوند یگانه معمولی نیست. این پیوند ویژگیهایی بین یک پیوند یگانه و دوگانه را دارا میباشد. به همین دلیل چرخش فضای برخلاف دیگر پیوندهای یگانه معمولی، برای این پیوند امکان پذیر نمیباشد. پیوندهای مجاور پیوند پپتیدی( کربنهای α که در دو طرف این پیوند قرار دارند) قابلیت چرخش داشته و با چرخشهای خود شکل فضایی پروتئین را مشخص میکنند. در این چرخشها، نوع و شکل زنجیره جانبی Rنقش تعیین کننده در نوع چرخش دارد.
![]() ساختمان دوم: ساختمان دوم پروتئین عموماً به شکل مارپیچی )هلیکس
یا ورقه چین خورده میباشد.. در میان انواع مختلف مارپیچها، نوع آلفا بیشترین فراوانی را دارد. در
این مارپیچ در هر دور 6/3 آمینواسید وجود داشته و
جهت چرخش در آمینواسید های طبیعی نوع L از راست به چپ و از بالا به پایین
میباشد. زنجیرههای جانبی نیز به سمت بیرون حلقه قرار میگیرند. در طول مارپیچ اکسیژن متصل به کربن
پپتیدی (کربن که تشکیل پیوند پپتیدی داده است) آمینواسید n با هیدروژن متصل
به نیتروژنی که به کربن پپتیدی n+4 متصل است، پیوند.
ساختمان دوم: ساختمان دوم پروتئین عموماً به شکل مارپیچی )هلیکس
یا ورقه چین خورده میباشد.. در میان انواع مختلف مارپیچها، نوع آلفا بیشترین فراوانی را دارد. در
این مارپیچ در هر دور 6/3 آمینواسید وجود داشته و
جهت چرخش در آمینواسید های طبیعی نوع L از راست به چپ و از بالا به پایین
میباشد. زنجیرههای جانبی نیز به سمت بیرون حلقه قرار میگیرند. در طول مارپیچ اکسیژن متصل به کربن
پپتیدی (کربن که تشکیل پیوند پپتیدی داده است) آمینواسید n با هیدروژن متصل
به نیتروژنی که به کربن پپتیدی n+4 متصل است، پیوند.
هیدروکسی پرولین به دلیل این که در این
آمینواسیدها گروه امین متصل به کربن پپتیدی فاقد هیدروژن است (دلیل آن این است که گروه امین در حلقه
قرار گرفته) لذا نمیتواند با ایجاد پیوند هیدروژنی که در بالا گفته شد سبب پایداری مارپیچ شود.
بنابراین پروتئین ها دارای مقادیر بالای اسیدامینه های پرولین و هیدروکسی پرولین( امینواسیدها)
تشکیل مارپیچ آلفا نمیدهند. دلیل اینکه پروتئین فاقد ساختار مارپیچی است، وجود مقادیر بالای این دو
امینواسید در آن میباشد.
همچنین وجود آمینه اسیدهای با بار مشابه به دلیل ایجاد نیروی دافعه و نیز وجود آمینه اسید ایزولوسین به دلیل ممانعت فضایی بالای زنجیره جانبی آن، تأثیر منفی روی تشکیل مارپیچ دارند.
در شکل ورقهای ساختمان دوم پروتئین، زاویه میان کربنهای آلفا و پیوند C – N بیشتر بوده و مولکول حالت کشیده و زیگزاگی دارد. به دلیل این ساختمان کشیدهتر امکان تشکیل پیوندهای هیدروژنی مانند آنچه در مارپیچ آلفا گفته شد وجود ندارد. در این حالت زنجیرههای جانبی در بالا و پایین صفحه قرار میگیرند. زنجیره جانبی امینواسید های هر صفحه با زنجیرههای جانبی امینواسید های صفحه مجاور پیوند هیدروژنی برقرار میکند. در صورتی که دو زنجیرهای که با هم پیوند هیدروژنی میدهند هم جهت باشند (مثلاً هر دو از انتهای N به سمت C باشد) به ساختمان به وجود آمده موازی و در غیر این صورت به ان غیر موازی می گویند.
ساختمان سوم: این ساختمان بر اثر تا خوردن زنجیره پروتئین در طول محور زنجیره و قرار گرفتن هر قسمت زنجیره کنار قسمتهای دیگر زنجیره به وجود می آید .مهمترین عامل پایدار کننده این ساختار پیوندهای هیدروژنی فراوانی است که میان قسمتهای زنجیره اصلی و نیز زنجیره اصلی با زنجیرههای جانبی بوجود می آید ،میباشد. میانکنش های آب گریز (هیدروفوب) نیز در پایداری مولکول دخالت داشته و با تجمع قسمتهای آب گریز در داخل و قسمتهای آب دوست (هیدروفیل) در بیرون بوجود می آید. البته همیشه اینطور نیست؛ مثلاً در پروتئین های نامحلول مانند لیپوپروتئین های حمل کننده چربی در خون تعداد زیادی آمینواسیدهای آب گریز در سطح پروتئین وجود دارد.
ساختمان چهارم: از اتصال دو یا چند زنجیره پپتیدی با پیوند غیر کوالان به یکدیگر به وجود می آید. به هر یک از این زنجیره ها یک زیر واحد می گویند. هموگلوبین )شامل 2 زیر واحد مارپیچ آلفا و 2 زیر واحد مارپیچ چین خورده بتا( میوزین با 6 زیر واحد و برخی از آنزیمها این نوع ساختار را دارند.
علاوه بر پیوندهای پپتیدی که تشکیل دهنده ساختار اول پروتئین میباشند، دیگر میانکنش های شرکت کننده در پایداری پروتئین عبارتند است:
پیوند هیدروژنی: انرژی آن 2-10 کیلوکالری بر مول میباشد.
پیوندهای دی سولفید: مانند پیوندهای پپتیدی از نوع کوالان بوده و میان گروههای سولفیدریل) SH( به وجود آمده و قسمتهای مختلف پروتئین را به هم متصل میکند که در نتیجه ان یک ساختار حلقوی در ساختار پروتئین به وجود می آید. انرژی این پیوند 80 کیلوکالری بر مول میباشد.
میانکنش های هیدروفوب: دارای انرژی 1-3 کیلوکالری بر مول میباشد. اگر زنجیرههای جانبی اسیدامینه های غیر قطبی در حلال قطبی قرار گیرند این زنجیرهها سعی در دوری از محیط کرده و کنار هم تجمع میکنند که به آن برهمکنش های هیدروفوب می گویند.
عوامل مؤثر بر ژلاتینه شدن و خصوصیات خمیر حاصل از ان
غلظت زیاد قند در محیط باعث کاهش میزان ژلاتینه شدن، کاهش حداکثر ویسکوزیته و کاهش استحکام ژل میشود. در این خصوص اثر دی ساکارید ها از منوساکاریدها بیشتر میباشد. تأثیر هر قند در کاهش میزان ژلاتینی شدن و کاهش ویسکوزیته و استحکام ژل عبارتند از:
ساکارز> لاکتوز> گلوکز> فروکتوز
ساکارز که همراه بودینگ است باعث کاهش ویسکوزیته و سفتی بیش از حد پودینگ میشود. البته غلظت کم قند میتواند باعث افزایش ویسکوزیته نشاسته ژلاتینی شده شود.
چربیها و اسیدهای چرب، منو، دی و تری گلیسریدها با تشکیل کمپلکس با امیلوز از یک طرف در مقابل نفوذ آب به داخل گرانول شده مقاومت کرده و از طرفی از خروج امیلوزهای کمپلکس شده را سخت میکند، بنابراین باعث اثر منفی روی ژلاتینی شدن، کاستن از افزایش ویسکوزیته و تشکیل ژل میشود. هنچنین کمپلکسهای چربی – امیلوز به سادیگی نمیتوانند در ایجاد اتصال بین گرانولها که برای ایجاد ژل مورد نیاز است، شرکت کنند.
PH خیلی پایین به دلیل تجزیه گرانولهای نشاسته و تبدیلان به تکههای کوچک ) بیشتر روی امیلوپکتین مؤثر است( مانند دکسترین ها که فاقد اثر غلیظ کنندگی هستند، حداکثر ویسکوزیته نشاسته را کاهش میدهند.
برای جلوگیری از این اثر میتوان از مولکولهای نشاسته متصل به هم مولکولهای نشاسته درشت استفاده کرد تا هیدرولیز اثر زیادی روی انها نگذارد.
در مراحل اولیه بیات شدن شدن، اتصالات زنجیرههای امیلوز مسئول ایجاد بیاتی در نان هستند .چربیها و مواد امولسیون کنند میتوانند از این بهم پیوستن رشتههای امیلوز جلوگیری کنند. بیات شدنی که در اثر نگهداری طولانی مدت نان ایجاد میشود ناشی از بهم پیوستن رشتههای امیلوپکتین میباشد. حرارت دادن با شکستن
این پیوندها و راندن مجدد آب بین رشتههای امیلوپکتین تا حدودی نان را به حالت اولیه بر میگرداند. بیات شدن در دماهای پایین )دما یخچال( سریعتر از دمای بالا اتفاق می افتد. انجماد به طور کامل از بیات شدن جلوگیری میکند.
نشاسته غلات مانند ذرت، گندم و برنج پس از سرد شدن، ژل سفت و مناسبی تشکیل میدهد و رنگان کدر است. در حالی که نشاسته ساقه ها و ریشه ها )سیب زمیی و کاساوا( ژل شفاف ولی ضعیفی را تشکیل میدهند.
نشاستهها پیش ژلاتینه شده جذب آب سریعتر داشته و برای ایجاد ویسکوزیته به دمای بالا نیاز ندارند.
نشاسته های تغییر یافته اصلاح شده:
با به کار گیری اسید برای هیدرولیز نشاسته، اسید قسمتهای امورف نشاسته که بیشتر امیلوپکتین است را هیدرولیز کرده و قسمتها کریستال که عمدتاً امیلوز است دست نخورده باقی میماند. در این صورت نشاسته تولید ویسکوزیته کمی داشته و به دمای بالایی برای افزایش ویسکوزیته نیاز دارد )چون نسبت امیلوز به امیلوپکتین ان افزایش یافته است(. این نشاسته برای استفاده در غذاهای کنسروی مناسب میباشد.
نوع دیگر نشاستههای اصلاح شده، نشاسته اکسید شده )با هیپوکلرید سدیم( میباشد که ویسکوزیته کمی داشته و شفاف هستند.
مهمترین نشاسته اصلاح شده ،نشاستههای فسفاته میباشند. نشاستههای مونو فسفاته وقتی به مواد غذایی افزوده میشوند باعث کاهش از دادن آب در هنگام انجماد زدایی ان میشوند. همچنین نشاستههای منوفسفاته در آب سرد نیز محلول میباشند. در نوع دیگری از نشاستههای فسفاته یک گروه فسفات بین دو عامل هیدروکسیل که عمدتاً متعلق به دو رنجیره مختلف نشاسته است اتصال ایجاد میکند. به این نوع نشاسته ،نشاسته اتصال یافته می گویند. این نشاستهها نسبت به نشاستههای معمولی کمتر متورم شده و در مقابل به هم زدن و هیدورلیز مقاوم میباشند. همچنین این نشاستهها دمای ژلاتینه شدن بسیار بالایی دارند.
– گلیکوژن
ذخیره کربوهیدراتی در بافتهای حیوانی بوده و در مقادیر کم در جگر و ماهیچه وجود دارد. از نظر ساختمانی شبیه امیلوپکتین بوه ولی وزن مولکولی و تعداد انشعابات ان بیشتر میباشد. در گلیکوژن پس از هر سه واحد گلوکز یک انشعاب 6 – 7 واحدی گلوکزی وجود دارد.
3.4.3 – تولید شربت ذرت
شربت ذرت یکی از فراوردههای نشاسته میباشد که دارای کاربرد وسیعی در صنایع غذایی است. انجام فرایند ممکن است توسط اسید و یا به گارگیری توام اسید و آنزیم صورت گیرد. پیشرفت واکنش هیدورلیز نشاسته با DE یا معادل دکستروز مشخص میشود که عبارتند از میزان کل قند احیاکننده به شکل دکستروز) D– گلوکز( که به صورت درصدان در ماده خشک محاسبه میشود. هیدرولیز اسیدی دارای محدودیت است زیرا از حد خاصی اگر فراتر رود، رنگ تیره و طعم تلخ در شربت ظاهر میشود. اگر هیدرولیز اسیدی در شرایط خشک انجام شود، تولید چسپ میکند.
در روش آنزیم – اسید، ابتدا تا
یک DE مشخص هیدرولیز انجام میشود و سپس بقیه فرایند با آنزیم انجام میشود.
در روش چند انزیمی، ایتدا نشاسته ژلاتینی شده و سپس با الفا امیلاز فرایند شروع شده و بعد با مخلوطی
از آنزیمها تا رسیدن به یک DE خاص ادامه مییابد. از هیدرولیز محدود نشاسته
ذرت
( DE برابر 10) مالتودکسیرین حاصل میشود که به عنوان
جایگرین چربی در غداهای اماده مورد استفاده قرار میگیرد.
برای تولید ذرت با فروکتوز بالا( HFCS)، ابتدا نشاسته به طور کامل هیدرولیز میشود، سپس با عبور از یک ستون که رویان گلوکز ایزومراز تثبیت شده است، بخشی از گلوکزان به فروکتوز تبدیل میشود. برای بدست آوردن شربت با فروکتوز بالاتر، شربت HFCS را از یک رزین تبادل کننده یون عبور میدهند که رزین فروکتوز را جذب میکند. پس از جداسازی فروکتوز میتوان شربتی با فروکتوز بالا تهیه کرد.
– سلولز
سلوبیوز که از دو مولکول گلوکز با اتصال( بتا 1-----4) تشکیل شده است، واحد تکرار شونده سلولز می باشد.
سلولز در برابر مواد شیمایی و عوامل طبیعی مقاوم میباشد. سلولز مانند امیلوز نشاسته فاقد انشعاب بوده ولی بر خلافان حالت ماپیچ و پیچ خورده ندارد، زیرا پیوندهای هیدروژنی میان گلوکز – گلوکز درساختمان سلولز طوری است که اجازه چرهش و پیچ خوردن را به ان نمیدهد.
زنجیرههای سلولز کنار یکدیگر قرار میگیرند، در نتیجه پیوندهای هیدروژنی زیادی میان این رنجیره ها تشکیل میشود. در بعضی از قسمتها، رنجیره ها بسیار به هم نزدیک میباشند و شکل منظم و کریستالی پیدا میکنند. در حالی که در قسمتهای دیگر زنجیرهها از هم فاصله میگیرند و ساختاری بی شکل و امورف را بوجود می اورند .اساساً جذب آب توسط سلولز منجصر به همین قسمتهای امورف میباشد. همچنین این قسمتهای امورف راحتر با مواد شیمایی مانند اسید واکنش میدهند.
در اثر هیدرولیز قسمتهای امورف سلولز با اسید ،کریستالهای ریز سلولز از قسمتهای کریستالیان ایجاد میشود که به ان ها اویسل می گویند. اویسل به دلیل این که بدن فاقد آنزیم سلولاز است، جذب نمیشود و برای ایجاد ویسکوزیته به سیستمهای غذایی اضافه میشود. همچنین ذرات ریزی از سلولز با قطر کمتر از یک میکرون تهیه شدهاند که احساس دهانی شبیه چربی داشته و به عنوان جایگزینهای چربی تحت نام سلوکریم تولید میشوند.
یک از مشتقات سلولز کربوکسی متیل سلولز( CMC) است که با اثر کلرواستیک روی سلولز ایجاد میشود. این ماده در مواد غذایی به عنوان غلیظ کننده، معلق کننده و پایدار کننده در حد وسیعی استفاده میشود. متیل سلولز یکی دیگر از مشتقات سلولز میباشد که در دمای بالا ایجاد ژل میکند ولی بر خلاف دیگر صمغها پس از سرد شدن مجدداً تبدیل به محلول میشود.
همچنین سلوفان که یک پوشش پسته بندی میباشد از سلولز ساخته میشود.
در هویج بر اثر مرور زمان با از دست دادن آب و افزایش اتصالات هیدورژنی میان زنجیرههای سلولز ،بافت سختی دران ایجاد میشود.
– همی سلولز
همی سلولزها میتوانند به صورت همی پلی ساکارید و هتروپلی ساکارید وجود داشته باشند. همی پلی ساکارید ها مانند گلوکان و مانان که به ترتیب پلیمری از گالاکتوز و مانوز هستند. اما اکثر همی سلولزها هتروپلی ساکاریدها بوده و از قندهای مانند ارابینوز، گزیلوز، اسید گلوکورونیک و تا حدودی قندهای داکسی ساخته شدهاند.
همی سلولز در آرد باعث افزایش قدرت جذب آب میشود و ویژگیهای مخلوط پذیری آرد را بهتر میکند.
همچنین بیات شدن نان را به تغییر انداخته و به عنوان فیبرهای رژیمی نیز مطرح میباشند.
– پکتین
پکتین پلیمری از اسیدهای گالاکتورونیک بوده که با اتصالات الفا) 1------4( به هم متصل هستند. تعدادی از گروههای کربوکسیل گالاکتورونیک اسید با اتانول متیله استری شدهاند. وقتی تمام گروههای کربوکسیل متیله شده باشند ،قسمتها متوکسیل 16 درصد وزن کل موکلول را تشکیل میدهند. اما معمولاً پکتین های موجود در طبیعت 9 – 12 درصد گروه متوکسیل دارند. درجه متیله بودن برابر است با تعداد گروههای متوکسیل به تعداد واحدهای اسید گالاکتورونیک تشکیل دهنده پکتین ضربدر 100.
در میوه های نارس، پکتین به سلولز متصل
بوه و به ان پروتوپکتین می گویند و در آب نامحلول میباشد. اگر تعدادی از گروههای متوکسیل جدا شوند
اسید پکتینیک تشکیل میشوند که محلول است و اگر تمام گروههای متوکسیل جدا
شوند اسید پکتیک تشکیل میشود که نامحلول میباشد. از پکتین برای ایجاد ویسکوزیته ،پایداری،
تعلیق مواد و قوام دادن در سیستمهای غذایی استفاده میشود. پکتین به عنوان یک امولسیون کننده نیز
کاربرد دارد.
تشکیل ژل توسط پکتین:
پکتین به دلیل گروههای باردار فراوان میتواند جذب آب زیادی داشته باشد. برای تولید ژل توسط پکتین وجود اسید و قند ضروری است. اسید با خنثی کردن گروههای با بار منفی کربوکسیل زمینه نزدیکی و اتصال زنجیرههای پکتین برای تشکیل ژل را فراهم میکند. قند نیز با گرفتن مقداری از مولکولهای آب زمینه این نزدیکی زنجیرههای پکتین را فراهم میکند. گفته شده است که قند با قرار گرفتن بین زنجیرههای پکتین نیز میتواند بین انها اتصال برقرار کند.
تشکیل ژل در 4/3 –PH= 2/8 صورت میگیرد. درصد قند مورد نیاز نیز 65 درصد میباشد. در PH بالاتر از 5/3 ژل تشکیل نمیشود. در PH کمتر از 8/2 نیز ژل در درجات حرارت زیاد تشکیل میشود.
پکتین های با درجه متیلاسیون کم، قند کمتری برای تشکیل ژل احتیاج دارند، البته به شرطی که فلزات دو ظرفیتی و مشخصاً کلسیم در محیط وجود داشته باشد. این فلزات دو ظرفیتی از طریق اتصال گروههای کربوکسیل به هم، زمینه را برای تشکیل ژل فراهم میکنند. پکتین با درجه متیلاسیون کمتر از 50 درصد، در حضور کلسیم، بدون حضور قند و در محدوده PH 5/2 تا 5/6 نیز میتواند ژل تشکیل دهد.
پکتین های با درجه متیلاسیون خیلی کم و خیلی زیاد )به ترتیب کمتر از 50 و بیشتر از 70 درصد( سریع ااً تشکیل ژل میدهند. در حالی که پکتین با درجه متیله شدن متوسط ) بین 50 – 70 درصد( به زمان طولانیتری برای تشکیل ژل احتیاج دارند.
درجه ژل سازی برابر از با مقدار پوند )یا کیلوگزم( ساکارزی که با یک پوند )یا کیلوگرم( پکتین در شرایط اسیدی مناسب تشکیل ژل میدهد. معمولاً درجه ژل سازی پکتین های موجود در بازار 150 – 300 میباشد.
پکتین را میتوان از پوست مرکبات و قسمت وسط سیب استخراج کرد. برای تولید پکتین بهتر از میوه کمی نارس با تازه رسیده باشد. با افزایش رسیدن میوه پکتین درجه متیله شدنش کمتر شده و نیز ممکن است زنجیره پکتین شکسته شود که در هر دو این حالات باعث کاهش قدرت تشکیل ژل پکتین میشود.
– صمغ ها
صمغها هیدروکلوئید هایی هستند که با جذب سبب افزایش ویسکوزیته و در نتیجه افزایش پایداری برخی سیستمهای غذایی میشوند. همچنین صمغها به عنوان جایگزین چربی نیز میتوانند به کار روند.
صمغ عربی: این صمغ از گیاه اکاسیا بدست آمده و برخلاف صمغهای دیگر در غلظتهای پایین ویسکوزیته کمی ایجاد کرده، ولی با افزایش غلظتان ویسکوزیته محلول به سرعت بالا میرود. صمغ عربی به دلیل داشتن گروههای باردار در PH های بالا و پایین پایداری کمی داشته و ویسکوزیته کمتری ایجاد میکند. این صمغ علاوه بر پایدارکنندگی، خاصیت امولسیون کنندگی نیز دارند .واحدهای ساختمانیان عبارتند از : L– ارابینوز ،L– رافینوز ،D– گالاکتوز و D – گلوکورونیک اسید. این صمغ به صورت لایهای روی مواد طعم زا قرار گرفته و با تثبیت انها ازجداشدنشان در طی فرایندها جلوگیری میکند. این صمغ با ژلاتین و ترگاکانت سازگاری خوبی ندارد.
ترگاکانت: در ایران به ان صمغ کتیرا می گویند. این صمغ از واحدهای D– گالاکتورونیک اسید ،L– فوکوس ،D– گالاکتوز ،D– گزیلوز و L– ارابینوز تشکیل شده است. این صمغ در شرایط حرارت بالا و محیط اسیدی پایداری زیادی داشته بنابراین در انواع سسها مانند کچاپ مورد استفاده قرار میگیرد.
با انحلال این صمغ در آب یک جزء محلول به نام تراگاکانتین و یک قسمت نامحلول به نام باسیورین تولید میشود.
الژینات: از جلبکهای قهوهای بدست می اید. مشتقات اسید الژنیک میباشند و از واحدهای بتا –D– مانوریک اسید و الفا –L– گلولورونیک اسید تشکیل یافته است .نمکهای فلزات قلیایی و امونیاکی الژینات ها به راحتی در آب سرد و گرم حل میشوند، ولی نمکهای فلزات دو یا سه ظرفیتی انها را نامحلول میکند. این صمغ در حضور کلسیم تشکیل ژل میدهد.
کارگینان: این صمغ به صورت پلیمری از هگزوزهای سولفاته میباشد و دارای 88 درصد گالاکتوز و مانوز و 5 درصد کربوهیدراتهای دیگر میباشد. 6 درصد پروتئین و 1 درصد نیز خاکستر دارد.
صمغ گوار: از اندوسپرم گیاه گوار بدست می اید. از نظر ساختمانی شیمیایی این صمغ از واحدهای بتا –D – مانوپرانوزیل که با اتصالات) 1----4( به یکدیگر متصل شدهاند، تشکیل یافته است. این واحدهای به صورت یک در میان به یک واحد گالاکتوپیرانوزیل متصل میباشند. اتصالات اخیر از نوع الفا (1----6) میباشند. این صمغ محلول غلیظی با خاصیت تیکسوتروپی به وجود میآورد. صمغ گوار از لحاظ الکتریکی خنثی بوده و ویسکوزیته ان تحت تأثیر PH قرار نمیگیرد.
دکستران: این صمغ میکروبی میباشد و از واحدهای بتا( 1----6) گلوکان تشکیل شده است.
زانتان: این نیز یک صمغ میکروبی میباشد که دارای وزن موکلولی بسیار بالایی است. واحدهای سازنده ان گلوکز، مانوز و اسید گالاکتورونیک میباشد. این صمع در آب سرد و گرم محلول بوده و محلولهای بیسار غلیظی تولید میکند
ژلان: توسط سودوموناس الودی تولید میشود.
منابع
شیمی مواد غذایی ، دکتر حسن فاطمی
- سرویس دهندهگروه دانش صنایع غذایی بندر
- تاریختیر 1399
- دسته بندی اخبار و مقالات
- لینک منبعwww.BandrFood..ir
- اشتراک




